自胰高糖素样肽-1(GLP-1)被发现以来,它已然成为一种“多面手”激素——多个代谢功能被人们发现,远远超出了其作为肠促胰岛素激素的经典定义。GLP-1的众多有益的多靶点作用使其受体激动剂逐渐成为更多新兴的治疗领域如脂肪肝、肥胖和神经退行性疾病等的冉冉之“星”。时值在我国临床上应用最广泛的GLP-1受体激动剂利拉鲁肽在我国上市10周年、司美格鲁肽在我国新上市之际,我们邀请一众专家讲述一系列关于GLP-1的故事。本次有请纪立农教授带您领略“三大营养物质如何刺激GLP-1分泌,神经内分泌和中枢对GLP-1分泌的调节机制,GLP-1何去何从的代谢问题”等大家关心的问题。
一、 GLP-1分泌的调节
L-细胞的肠道分布
我们知道肠道L-细胞分泌胰高糖素样物质。那么L-细胞又分布在肠道哪些部位呢?
大鼠、猪和人的大多数L-细胞位于肠远端上皮层[1]。L-细胞的顶端面面向肠腔,可与肠腔营养物质直接接触(图1)[1]。与此相一致的是,健康人在将碳水化合物或脂类直接注入回肠后,血浆GLP-1水平迅速升高[2]。营养物质与远端肠道的L-细胞的接触可能解释了餐时GLP-1升高持续时间的延长,也可能是在胃旁路手术和袖状胃切除术后,GLP-1水平通常升高的原因[3-8]。因为手术对远端肠道重新定位能使远端肠道的L-细胞更快地暴露于进入消化道的营养物质中[9]。
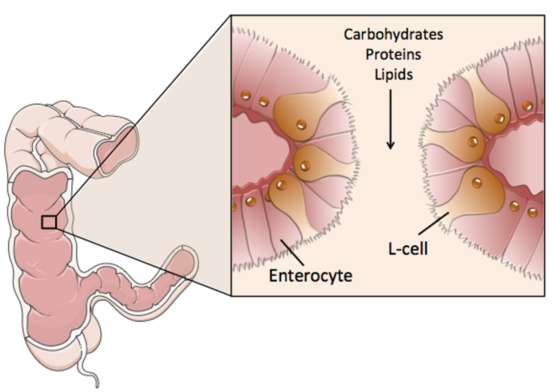
图1 L-细胞分布示意图
GLP-1分泌量受进食量和食物构成的影响[10]。在健康志愿者中,520kcal的口服膳食比260kcal膳食更能诱导血浆总GLP-1增加[10]。促进GLP-1分泌的营养物质包括可代谢的单糖,如葡萄糖、果糖和半乳糖[11-15],不可代谢单糖,如甲基-α-葡萄糖苷[12],长链脂肪酸[16-19],蛋白质[15,20-24]和某些氨基酸[25-27]。在健康人中,摄入碳水化合物或蛋白质引起循环GLP-1迅速增加,可在30-60分钟达到峰值,而摄入脂类引起的循环GLP-1增加稍晚一些,但持续时间更长(>120分钟)[11,28]。
糖类物质对GLP-1分泌的影响
刺激GLP-1分泌的单糖包括葡萄糖、半乳糖和果糖[11,12]。在肠内分泌的GLUTag细胞中,葡萄糖和果糖通过关闭ATP敏感的KATP通道和膜去极化,打开电压门控Ca2+(VDC)通道,由此产生的Ca2+内流然后触发囊泡胞吐和剂量依赖性刺激GLP-1的分泌进入循环(图2)[12,14,29,30]。在体外已经证实了KATP通道活性在介导GLP-1释放中的重要性,同时也证实人L-细胞中存在KATP通道的Kir6.2/SUR1通道复合物[31],但KATP通道的Kir6.2/SUR1通道复合物是否在人体中介导GLP-1释放这一过程的作用还有待证实。
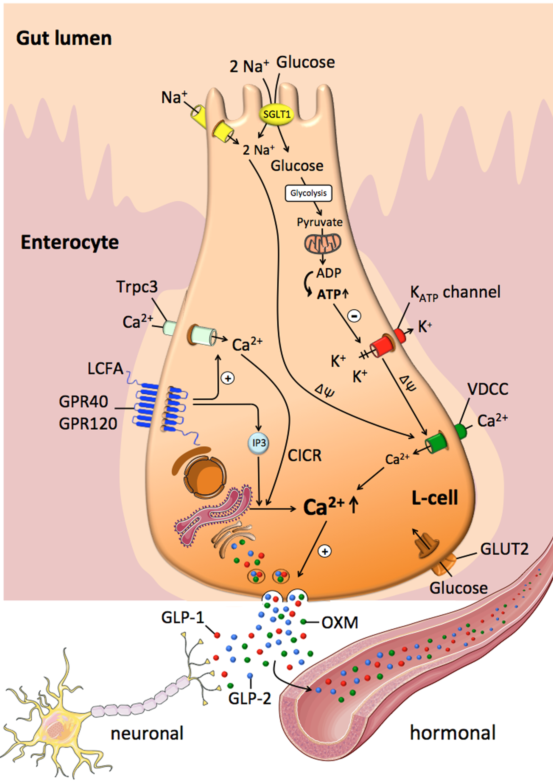
图2 L-细胞内营养物质刺激GLP-1分泌的示意图
CICR:钙诱导的钙释放;LCFA:长链脂肪酸;GLUT2:葡萄糖转运体2;GLP-1:胰高糖素样肽-1;GLP-2:胰高糖素样肽-2;OXM: 胃泌酸调节素;Trpc3:瞬时受体电位通道3;VDCC:电压门控钙通道;SGLT1:钠-葡萄糖共转运体1。
L-细胞对葡萄糖的摄取似乎是通过GLUT2和SGLT1两种途径介导的(图2)[32,34],其中电压SGLT1介导的葡萄糖摄取对于刺激分泌耦联过程尤为重要。果糖刺激GLP-1分泌在大鼠、小鼠、人类和GLUTag细胞中得到证实[14,35]。然而口服果糖时,其对GLP-1的促分泌作用远不如等热量负荷的葡萄糖强[14]。
膳食脂质对GLP-1分泌的影响
L-细胞通过特定的细胞表面受体感知膳食中的脂质,这些受体和脂质的代谢产物相结合[36](图3)诱导GLP-1分泌,这主要发生在L-细胞的基底外侧。至于膳食甘油三酯,L-细胞不仅对其产生的游离脂肪酸有反应,而且对其主要代谢产物2-单酰甘油(2-MAG)也有反应,并似乎协同发挥作用[37]。
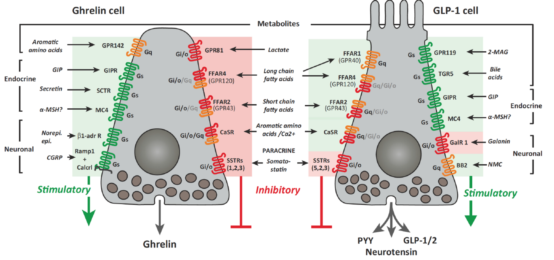
图3 表达脑肠肽或GLP-1的胃细胞中调控激素分泌的GPCR序列示意图绿色或红色背景色表示受体激活时刺激
(绿色)或抑制(红色)激素分泌。受体的颜色通过G/s(绿色)、G/q(橙色)或G/i/o(红色)代表G蛋白信号。对所有受体而言,影响激素分泌的G蛋白类型尚未确定;对于那些还没有被描述的G蛋白(受体),根据其他细胞研究的数据标注了最有可能的耦联情况。
2-MAG:2-单酰甘油;BB2:蚕毒素受体2;Calcrl:降钙素受体样受体;CaSR:钙感知受体;CGRP:降钙素基因相关肽;FACS:流式细胞术;FFAR:游离脂肪酸受体;GalR1:神经节肽受体1;GIP:葡萄糖依赖型胰岛素性肽;GIPR:GIP受体;GPR:G蛋白受体;MC$:黑皮质素4;MSH:促黑激素;NMC:神经介肽C;PYY:多肽YY;Ramp1:受体活性修饰蛋白1;SCTR:分泌素受体T;SSTR:生长抑素受体;TGR5:胆汁酸受体。
α-亚麻酸(C18:3)、二十二碳己酸(C22:6)、棕榈油酸(C16:1)、油酸(C18:1)、硬脂酸(C18:0)和辛酸(C8:0)刺激的GLP-1分泌明显较少,且依赖于脂肪酸的剂量[17]。在人体中,不饱和脂肪酸比饱和脂肪酸刺激GLP-1分泌的作用更有效[38,39]。
游离脂肪酸(FFAs)通过细胞表面(最有可能是L型)Ca2+通道[40]刺激Ca2+内流,增加细胞内Ca2+浓度,进而促进GLP-1的分泌,此作用高度依赖于胞质Ca2+浓度。
参与FFA调节GLP-1分泌的受体包括GPR120(FFAR4)和GPR40(FFAR1),它们都是由长链脂肪酸激活的,其中以GPR40刺激GLP-1的分泌的作用更为主要。膳食甘油三酯的另一主要代谢物2-MAG也是一种非常强大的GLP-1促泌剂,其通过GPR119发挥作用[41,42]。值得一提的是,GLP-1在GPR40敲除动物和GPR119敲除小鼠中对膳食脂肪的反应大大降低,反之Gq耦联GPR40激动剂与Gs耦联GPR119激动剂产生协同作用,可强烈刺激GLP-1分泌[37,43]。
另外,油酸可以通过不耦联的氧化磷酸化作用刺激GLP-1非受体依赖性从GLUTag细胞中的释放,间接刺激糖酵解,从而激活上述机制[44]。
蛋白质/氨基酸对GLP-1分泌的影响
蛋白质和氨基酸可以刺激GLP-1分泌。在健康志愿者中,30%能量来源于蛋白质(40%碳水化合物,30%脂肪)的饮食比10%能量来源于蛋白质(60%碳水化合物,30%脂肪)的饮食更能刺激GLP-1分泌[45]。单个氨基酸如谷氨酰胺、天冬酰胺、苯丙氨酸、甘氨酸、亮氨酸、异亮氨酸、缬氨酸以及脱脂牛奶、酪蛋白和乳清可刺激GLP-1分泌[46],其中谷氨酰胺和甘氨酸效果最明显[25-27]。L-精氨酸作为一种有效的胰岛素促泌剂[47],它也能刺激离体大鼠肠道释放GLP-1,当口服时,可提升小鼠GLP-1和胰岛素水平,并改善葡萄糖耐受性,但在GLP-1受体敲除小鼠中此作用不存在[48]。
其他诸如肉蛋白水解产物[19]、玉米蛋白[23]、蛋白胨[15]、果胶[49]、小麦蛋白水解物的低分子部分(LWP)[50]也都被研究发现可刺激各种离体细胞,离体结肠回肠中刺激GLP-1分泌 。
蛋白刺激GLP-1分泌的分子机制包括Ca2+激活/钙调素依赖性激酶Ⅱ的激活[50]。大量证据支持肽类物质介导的GLP-1分泌是一个Ca2+敏感激活过程,通过Ca2+敏感受体(CaSR)和肽转运体1(PEPT1)的L-细胞信号传导[51]。
内分泌因素对GLP-1分泌的影响
01 肠道GLP-1分泌的内分泌调节
L-细胞在肠道的分布(远端肠道丰度高,近端肠道丰度低)表明存在近端至远端协调环路。在该环路中,近端肠产生的神经元和/或内分泌因子影响远端区域的L-细胞GLP-1分泌。
近端肠中L细胞数量虽然较少,也足以在营养摄入后快速诱导GLP-1分泌[52-54]。此时远端肠道的L-细胞尚未与肠腔营养物质直接接触,这个近端肠道的L细胞刺激分泌的GLP-1可能对餐后早期阶段很重要。在啮齿动物中,已观察到GLP-1的双相分泌;这表明GLP-1分泌的一个快速相是由上消化道的L-细胞直接刺激引起的,第二相可能是由来自上消化道的信号到达下小肠甚至是大肠引起的[55,56]。GIP和肠壁内自主神经系统被认为是信号通路[55]。K-细胞中GIP在近端肠道中表达最高,其循环水平在食物摄入[57-59]或当营养物质直接进入十二指肠[50,60,61]时迅速增加。GIP调节GLP-1的分泌需要通过迷走神经传入或传出信号传输[61]。在人体中,当十二指肠葡萄糖输送速率超过其吸收限度,即未吸收的葡萄糖到达空肠或其他地方,GLP-1才会受到强烈刺激反应性分泌。相反,GIP分泌则可以是由极低的胃葡萄糖递送率刺激,因此近端肠中K-细胞产生GIP的丰度比L-细胞产生的GLP-1更高[62]。
迷走神经元和肠神经元表达的神经递质包括乙酰胆碱和GRP能够增加GLP-1分泌,支持了近端-远端神经内分泌环路这一假说[63]。乙酰胆碱受体,包括毒蕈碱受体M1、M2和M3在大鼠L-细胞[64]和人NCL-H716细胞[65]中均有表达。去甲肾上腺素可以通过作用于α-肾上腺素受体抑制GLP-1的分泌,而异丙肾上腺素刺激GLP-1分泌可被β-肾上腺素能受体拮抗剂普萘洛尔阻断[66]。所以,肠道GLP-1的分泌受胆碱能和β-肾上腺素能受体信号刺激而增加,但因α-肾上腺素能受体的激活而被抑制。GRP由肠神经系统GRP能神经元产生和释放[67]。在大鼠中,当脂肪直接注入十二指肠时,输注GRP可刺激GLP-1的分泌,刺激胰腺中的胰岛素分泌[68],并进一步延迟胃排空[69,70]。
综上,营养物质诱导小肠近端的L-细胞分泌GLP-1,此时GLP-1的分泌早于胃排空。餐后葡萄糖浓度超过近端肠的吸收能力,因此摄入的葡萄糖迅速到达较远端的L-细胞进行GLP-1分泌。此外营养物质触发近端肠道GIP的释放。GIP刺激迷走神经传入传递,随后激活迷走传出神经元和肠神经元,释放乙酰胆碱和/或GRP来刺激远端肠道释放GLP-1,触发GLP-1分泌,而营养物质如能到达远端肠道时,与L-细胞的直接接触也会触发GLP-1分泌进入循环。
02 、中枢GLP-1分泌的内分泌调节
后脑孤束核(NTS)尾部的的GCG+神经元是内源性脑GLP-1的主要来源[71]。NTS中产生GLP-1的PPG神经元是直接接受迷走神经传入信号输入的二级神经元[72],可被多种外周信号激活调节摄食行为等多个方面。值得注意的是,后脑GCG+神经元缺乏GLP-1受体,因此它们不能被外周来源的GLP-1直接激活[72]。
二、 GLP-1降解
天然GLP-1的半衰期非常短,其半衰期约为1-2分钟[73],究其原因为两个:(a)二肽基肽酶-4(DPP-4)的作用和(b)肾脏排泄。DPP-4在N-端二肽段切割GLP-1(7-36酰胺)和GLP-1(7-37)生成GLP-1(9-36酰胺)或GLP-1(9-37),成为GLP-1受体的低亲和力配体[74,75],通过肾脏迅速从血液循环中清除。
DPP-4以两种形式存在,分别是跨膜细胞表面蛋白和循环蛋白,两种形式都有超出其蛋白水解活性的作用[76]。DPP-4在肠细胞刷状缘和内皮细胞中高表达[77],大部分GLP-1在远端肠道的毛细血管中被DPP-4降解,仅不足25%的活性GLP-1到达肝脏,只有不足10%~15%进入循环[3,77,78]。DPP-4生成的GLP-1代谢物[GLP-1(9-36酰胺)和GLP-1(9-37)]在调节糖代谢中作用甚微[79]。但对于缺血后小鼠再灌注时,可改善心脏的心排血量,并影响小鼠肠系膜动脉的血管舒张[80]。

纪立农教授
今年是胰岛素诞生100周年,在胰岛素被发现后人类又从对胰岛素的研究中探寻出来许多其他和血糖代谢相关的激素。GLP-1就是这当中被转化为治疗糖尿病的重要激素,其衍生出来的药物在临床中得到越来越广泛的应用。2009年,第一个被开发成GLP-1类药物的艾塞那肽开始在我国临床应用。第一个被证实有心血管保护作用的利拉鲁肽也在我国临床应用了10年,今年我国又迎来了另外一个在已经上市的GLP-1类似物中降糖和改善体重作用最强的司美格鲁肽,为我国临床治疗糖尿病提供了更新的武器。从1968年Unger报道了胰高血糖素样反应至今人们将GLP-1应用于2型糖尿病、肥胖、脂肪肝等多个领域的临床治疗和探索也已经经历了半个多世纪。我们有理由相信随着科学的进步及医疗技术的发展,GLP-1也会有更多的作用被人类发掘和应用。更期待这一“明星般”的激素能够为未来的疾病管理带来更卓越的成效。
